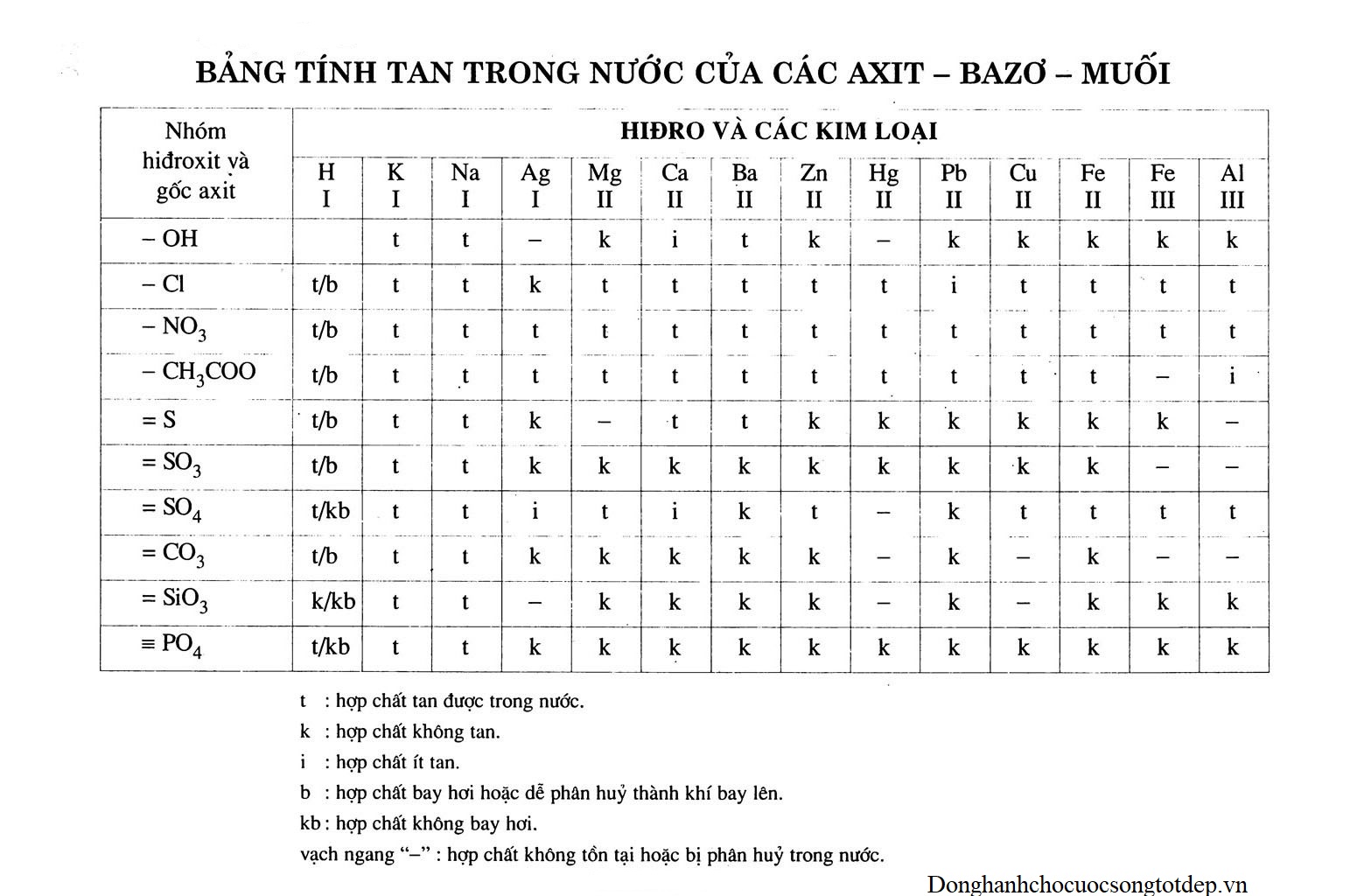
Tìm hiểu sự khác biệt trong khả năng hòa tan của Canxi Hydroxit so với các hydroxit kim loại khác, cung cấp cái nhìn sâu sắc cho doanh nghiệp và nhà nghiên cứu về đặc tính hóa học của chúng. Tìm hiểu sâu hơn cùng GH Group thông qua bài viết này.
Giới thiệu chung
Trong ngành công nghiệp hóa chất hiện đại, những hợp chất vô cơ đảm nhận vai trò quan trọng. Nổi bật lên là, các hydroxit kim loại là một nhóm hợp chất quan trọng. Chúng được ứng dụng rộng rãi qua nhiều công đoạn sản xuất. Trong lĩnh vực xử lý nước, trong ngành vật liệu xây dựng, và cả trong công nghiệp dược phẩm, các hydroxit kim loại đều hiện diện.

Một trong những tính chất hóa học quan trọng nhất liên quan đến các hydroxit kim loại chính là khả năng hòa tan trong môi trường nước. Mức độ hòa tan này không chỉ nói lên cấu trúc phân tử, mà còn chi phối trực tiếp đến hành vi của chúng trong quá trình phản ứng hóa học và các ứng dụng công nghiệp cụ thể. Sự khác biệt về độ hòa tan giữa các loại hydroxit kim loại khác nhau là một yếu tố then chốt đòi hỏi sự hiểu biết sâu sắc nhằm mục đích tối ưu hóa quy trình và chọn lựa vật liệu một cách thích hợp.
Mục đích của bài viết này sẽ thực hiện việc phân tích và đối chiếu khả năng hòa tan của Ca(OH)2 với một số hydroxit kim loại khác được sử dụng rộng rãi. Thông qua việc trình bày những dữ liệu mang tính khoa học, phân tích các yếu tố ảnh hưởng và bàn luận về các ứng dụng thực tiễn, chúng tôi hy vọng mang đến một góc nhìn đầy đủ và được hỗ trợ bởi các dữ liệu khoa học về đặc tính hòa tan của những hợp chất quan trọng này. Việc này sẽ giúp các chuyên gia nghiên cứu và các tổ chức doanh nghiệp trong ngành hóa chất trong quá trình ra quyết định đúng đắn và mang lại hiệu quả.
Các nội dung trọng tâm
Tổng quan về tính tan của hydroxit kim loại
Tính tan của một chất trong một dung môi được định nghĩa là giới hạn nồng độ tối đa của chất tan có thể phân tán trong một khối lượng xác định dung môi ở một nhiệt độ và áp suất xác định. Đối với các hydroxit kim loại, độ hòa tan trong nước đại diện cho một đặc điểm vật lý cốt lõi. Nó ảnh hưởng trực tiếp việc chúng có thể tồn tại dưới dạng ion hòa tan trong dung dịch chứa nước.
Đối với các nhà hóa học, tính tan có ý nghĩa sâu sắc. Nó có mối liên hệ trực tiếp đến năng lực phản ứng của những hợp chất hydroxit này. Nếu một hydroxit có mức độ tan cao hơn thường thể hiện xu hướng phân tách mạnh mẽ hơn khi tiếp xúc với nước, tạo ra nhiều ion hydroxit (OH-). Điều này chi phối đến đặc tính bazơ của dung dịch và khả năng tương tác vào các phản ứng trung hòa. Trong ứng dụng công nghiệp, mức độ tan ảnh hưởng kết quả của các quá trình như việc xử lý nước, quá trình kết tủa, hay điều chỉnh giá trị pH.
Có nhiều yếu tố có tác động đến tính tan của chúng. Các yếu tố chính bao gồm:
Yếu tố nhiệt độ: Trong trường hợp của hầu hết các hydroxit kim loại, độ hòa tan giảm khi nhiệt độ tăng. Lý do cho điều này là quá trình hòa tan của chúng thường mang tính chất tỏa nhiệt. Song, có những trường hợp ngoại lệ.
Môi trường pH: pH ảnh hưởng đáng kể đến sự thiết lập cân bằng giữa hydroxit rắn và các ion hòa tan. Trong môi trường axit, độ hòa tan của hydroxit thường được cải thiện do sự phản ứng của các ion OH- với ion hydro (H+) hình thành phân tử nước. Trái lại, trong môi trường bazơ mạnh, mức độ tan của một số hydroxit có thể bị giảm xuống do hiệu ứng ion chung. Tuy nhiên, cần lưu ý rằng, các hydroxit có tính chất lưỡng tính chẳng hạn như Al(OH)3 lại có thể hòa tan khi ở trong môi trường axit mạnh cũng như trong môi trường bazơ mạnh.
Cấu trúc mạng tinh thể: Năng lượng của mạng lưới tinh thể của chúng cũng như năng lượng hydrat hóa của các ion kim loại tương ứng có tác động đến sự cân bằng tan. Hydroxit có năng lượng mạng lưới thấp cùng với năng lượng hydrat hóa cao cho ion kim loại thường có độ hòa tan cao hơn.
Tính chất của cation kim loại: Kích thước và điện tích của ion của ion kim loại tương ứng ảnh hưởng đến lực hút giữa ion kim loại và ion hydroxit. Các ion kim loại có điện tích nhỏ và bán kính lớn hơn thường có xu hướng tạo ra các hydroxit có mức độ tan cao hơn trong cùng một chu kỳ hoặc nhóm. Chẳng hạn như, hydroxit của các kim loại kiềm (Nhóm IA) thường có tính tan tốt hơn nhóm hydroxit kim loại kiềm thổ (Nhóm IIA trong bảng tuần hoàn).
Tìm hiểu đặc điểm riêng của Ca(OH)2
Canxi Hydroxit là một loại hợp chất vô cơ mang công thức hóa học Ca(OH)2. Người ta còn gọi nó là là vôi tôi. Tại điều kiện chuẩn, Ca(OH)2 là chất rắn màu trắng đặc trưng, ít tan trong nước. Dung dịch bão hòa của Hydroxit Canxi được gọi là nước vôi trong. Liên quan đến đặc tính hóa học, Nó là một bazơ mạnh. Nó có thể phản ứng với các loại axit sản sinh ra muối và nước, tương tác với oxit axit ví dụ như CO2 tạo ra kết tủa CaCO3.
Độ hòa tan của Ca(OH)2 trong nước đại diện cho một đặc điểm khá đặc biệt trong nhóm hydroxit kim loại kiềm thổ. Tại nhiệt độ 20 độ C, tính tan của Ca(OH)2 là xấp xỉ 1,73 g/L. Số liệu này cho thấy Ca(OH)2 không tan tốt như các hydroxit của kim loại kiềm (như NaOH, KOH), nhưng khả năng hòa tan lại cao hơn so với nhiều loại hydroxit kim loại khác trong những nhóm khác.
Một điều cần quan tâm về khả năng hòa tan của Ca(OH)2 là mối liên hệ phụ thuộc ngược chiều vào nhiệt độ. Khác với đa số các chất rắn, mức độ tan của Ca(OH)2 giảm đi khi nhiệt độ được nâng cao. Chẳng hạn, ở nhiệt độ sôi (100°C), độ hòa tan của nó chỉ còn xấp xỉ 0,77 gam trên lít. Sự phụ thuộc ngược chiều này phản ánh bản chất tỏa nhiệt đặc trưng khi Ca(OH)2 hòa tan. Khi nhiệt độ tăng, điểm cân bằng hòa tan dịch chuyển theo chiều tạo thành chất rắn, khiến lượng Ca(OH)2 giảm đi có thể hòa tan.
Ca(OH)2 tìm thấy nhiều ứng dụng có ý nghĩa trong công nghiệp cũng như trong nông nghiệp. Trong xử lý nước, nó được áp dụng để nâng cao độ pH, làm giảm độ cứng của nước và loại bỏ các ion kim loại nặng có trong nước. Trong ngành xây dựng, Ca(OH)2 là một thành phần cốt yếu của các loại vữa và xi măng. Trong lĩnh vực nông nghiệp, nó được dùng cho việc cải tạo đất chua cũng như làm thuốc bảo vệ thực vật. Tính bazơ và độ hòa tan tương đối của Hydroxit Canxi biến nó thành một loại hóa chất linh hoạt và hiệu quả.
3. So sánh độ hòa tan của Ca(OH)2 với các hydroxit kim loại khác
Để có cái nhìn rõ ràng hơn, chúng ta hãy so sánh mức độ tan của Ca(OH)2 với những hydroxit kim loại thường gặp trong thực tế và có ứng dụng trong các lĩnh vực khác nhau. Hoạt động so sánh này sẽ làm nổi bật lên sự khác biệt về thuộc tính và làm rõ nguyên nhân cho những ứng dụng chuyên biệt của mỗi loại hydroxit.
a. Hydroxit nhôm (Al(OH)3)
Al(OH)3 là một hydroxit có tính lưỡng tính. Điều này ngụ ý rằng nó có thể kết hợp với cả axit mạnh lẫn bazơ mạnh. Song, tính tan của Al(OH)3 khi ở trong nước tinh khiết là rất thấp. Ở 20 độ C, khả năng hòa tan của Al(OH)3 chỉ vào khoảng 0,007 g/L. Con số về độ hòa tan này thấp hơn rất nhiều so với khả năng hòa tan của Ca(OH)2 (xấp xỉ 1,73 g/L). Sự chênh lệch này được lý giải thông qua năng lượng mạng lưới tinh thể ở mức cao hơn của Al(OH)3 và sự khác biệt về bản chất liên kết. Tuy Al(OH)3 có thể tan khi ở trong axit và bazơ mạnh do hình thành phức chất, tính tan trong nước trung tính vẫn ở mức rất thấp.
Hydroxit sắt
Fe(OH)3 là một loại hydroxit của một kim loại chuyển tiếp. Nó thường tồn tại ở dạng kết tủa với màu nâu đỏ. Mức độ tan của Fe(OH)3 trong nước gần như bằng không. Nó được xem là một trong những loại hydroxit ít tan nhất trong nhóm các hydroxit kim loại. Giá trị độ hòa tan của nó thường được biểu thị dựa trên tích số tan Ksp, có giá trị rất nhỏ. Độ hòa tan thấp này biến Fe(OH)3 thành trở thành một lựa chọn thích hợp trong các ứng dụng liên quan đến kết tủa cũng như loại bỏ ion sắt khỏi dung dịch, điển hình là trong xử lý nước thải. Sự khác biệt lớn về độ hòa tan giữa Ca(OH)2 và Fe(OH)3 thể hiện sự khác biệt liên quan đến bản chất liên kết và cấu trúc tinh thể giữa hai hợp chất này.
Magiê Hydroxit
Mg(OH)2 đại diện cho một hydroxit của kim loại kiềm thổ, cùng nhóm với Canxi trong bảng tuần hoàn. Tuy nhiên, khác với Ca(OH)2, khả năng hòa tan của Mg(OH)2 trong nước lại có giá trị thấp hơn so với Hydroxit Canxi. Ở 20 độ C, mức độ tan của Mg(OH)2 chỉ đạt xấp xỉ 0,0009 gam trên lít. Số liệu này thấp hơn rõ rệt so với Ca(OH)2. Sự chênh lệch trong khả năng hòa tan giữa Mg(OH)2 và Ca(OH)2 trong cùng một nhóm có thể được làm rõ thông qua sự khác biệt liên quan đến năng lượng mạng lưới cũng như năng lượng hydrat hóa của ion Mg2+ khi so sánh với ion Ca2+. Dù ion Mg2+ nhỏ hơn ion Canxi (Ca2+), năng lượng mạng lưới của Mg(OH)2 lại cao hơn đáng kể bởi khoảng cách giữa các ion ngắn hơn. Điều này đòi hỏi năng lượng lớn hơn để phá vỡ cấu trúc mạng lưới, kết quả là độ hòa tan thấp hơn. Mg(OH)2 tìm thấy ứng dụng làm thuốc kháng axit và chất chống cháy, tận dụng đặc tính ít tan và tính bazơ yếu.
Hydroxit chì
Hydroxit chì(II) là một hydroxit của một kim loại nặng. Nó cũng là một loại chất rắn có tính chất ít tan trong nước. Mức độ tan của Pb(OH)2 biến đổi tùy thuộc vào môi trường pH và sự tồn tại của các ion khác. Song, trong môi trường nước trung tính, mức độ tan của nó thường có giá trị thấp hơn so với Hydroxit Canxi. Giá trị độ hòa tan của nó có thể vào khoảng 0,3 g/L ở điều kiện nhất định, nhưng giá trị này có thể biến động rõ rệt. Hydroxit chì(II) cũng mang tính lưỡng tính, có khả năng tan trong axit và bazơ mạnh. caoh2 có tan không độc hại của chì và các hợp chất chứa chì làm cho Pb(OH)2 trở thành ít được áp dụng trong các lĩnh vực như thực phẩm hoặc dược phẩm. Tuy nhiên, nó vẫn được sử dụng nó vẫn được sử dụng trong một số quy trình công nghiệp chuyên dụng, ví dụ trong sản xuất một số loại sơn.
Phân tích nguyên nhân dẫn đến sự khác biệt về khả năng hòa tan
Sự khác biệt rõ rệt về độ hòa tan giữa Hydroxit Canxi và các hydroxit kim loại khác có thể được lý giải một cách hệ thống dựa vào những yếu tố đã đề cập ở mục 1. Cụ thể:
Bản chất của ion kim loại: Canxi là một loại kim loại kiềm thổ với bán kính ion khá lớn so với Mg. Trong cùng một nhóm, khi đi từ trên xuống, kích thước ion tăng. Ion Ca2+ có năng lượng mạng lưới của Hydroxit Canxi ở mức thấp hơn so với Mg(OH)2. Năng lượng liên quan đến quá trình hydrat hóa của ion Canxi (Ca2+) cũng khác so với ion Magiê (Mg2+). Sự cân bằng giữa năng lượng mạng lưới và năng lượng hydrat hóa của ion quyết định mức độ tan. Với các kim loại chuyển tiếp như Sắt và Chì, bản chất liên kết hóa học trong các hydroxit của chúng thường có đặc điểm cộng hóa trị cao hơn so với các kim loại kiềm thổ. Việc này dẫn đến năng lượng mạng lưới rất cao cũng như độ hòa tan cực kỳ thấp.
Khả năng lưỡng tính: Sự hiện diện của tính lưỡng tính ở Al(OH)3 và Pb(OH)2 giúp chúng có thể hòa tan trong môi trường axit mạnh và bazơ mạnh. Tuy nhiên, trong nước trung tính, trong môi trường nước trung tính, mức độ tan của chúng vẫn rất thấp. Ca(OH)2 không thể hiện tính lưỡng tính, chính vì thế khả năng hòa tan của nó chủ yếu được quyết định bởi trạng thái cân bằng giữa pha rắn và các ion hòa tan.
Sự ảnh hưởng của nhiệt độ và pH: Như đã trình bày, mức độ tan của Ca(OH)2 trở nên thấp hơn khi nhiệt độ tăng. Đối với những hydroxit khác, sự phụ thuộc vào nhiệt độ có thể có sự khác biệt. Đồng thời, môi trường pH ảnh hưởng đến tính tan của tất cả những hydroxit này, nhưng mức độ ảnh hưởng và hướng của sự thay đổi có thể khác nhau tùy thuộc vào bản chất của hydroxit của từng loại.

Để dễ hình dung, có thể tham khảo bảng so sánh về khả năng hòa tan ước tính của các hydroxit đã thảo luận tại nhiệt độ 20°C (trong nước tinh khiết):
| Tên Hydroxit | Công thức | Độ hòa tan ước tính (g/L ở 20°C) |
| :--------------------- | :-------- | :---------------------------------------------- |
| Hydroxit Canxi | Ca(OH)2 | ~1.73 |
| Al(OH)3 | Al(OH)3 | ~0.007 |
| Hydroxit Sắt(III) | Fe(OH)3 | Rất thấp (xem Ksp) |
| Mg(OH)2 | Mg(OH)2 | ~0.0009 |
| Chì(II) Hydroxit | Pb(OH)2 | Xấp xỉ 0.3 (tùy thuộc) |
Lưu ý: Các giá trị độ hòa tan có thể khác nhau dựa trên nguồn tham khảo. Bảng này chỉ nhằm mục đích minh họa để cho thấy sự khác biệt tương đối giữa các hydroxit.
Ứng dụng của hydroxit kim loại liên quan đến tính tan
Mức độ tan của một hydroxit kim loại chi phối mạnh mẽ đến các ứng dụng trong công nghiệp. Sự lựa chọn hydroxit thích hợp cho một mục đích cụ thể thường được dựa trên đặc điểm hòa tan cần thiết.

Điển hình là Ca(OH)2: Khả năng hòa tan tương đối ở mức cao hơn so với nhiều loại hydroxit kim loại khác làm cho nó trở thành lựa chọn lý tưởng trong các ứng dụng cần một nguồn ion OH- ở nồng độ vừa phải. Khi xử lý nước, Ca(OH)2 được dùng cho việc điều chỉnh pH của nước thải, thực hiện quá trình trung hòa axit và tạo kết tủa những ion kim loại dưới dạng hydroxit. Tính tan của nó đủ để cung cấp một lượng lượng ion hydroxit cần thiết đủ cho phản ứng, nhưng không quá lớn để gây ra nồng độ ion ở mức quá cao trong nước sau khi đã xử lý. Đối với nông nghiệp, độ hòa tan này giúp Ca(OH)2 phân tán một cách từ từ khi ở trong đất, giúp cải tạo đất chua một cách hiệu quả mà không làm thay đổi pH đột ngột cho cây trồng.
Ngược lại, các hydroxit có độ hòa tan cực kỳ thấp ví dụ như Fe(OH)3 và Al(OH)3 lại được sử dụng ưu tiên trong các ứng dụng yêu cầu loại bỏ những ion kim loại khỏi dung dịch bằng phương pháp kết tủa. Tính tan thấp đảm bảo rằng ion kim loại sẽ kết tủa gần như toàn bộ khi độ pH được điều chỉnh, giúp làm sạch nước hay thu hồi kim loại một cách hiệu quả. Al(OH)3 cũng được sử dụng làm chất kết tủa trong các quy trình xử lý nước, đặc biệt là cho việc loại bỏ những hạt lơ lửng qua quá trình keo tụ và kết tủa.
Mg(OH)2 cùng với tính tan thấp hơn so với Ca(OH)2 nhưng vẫn đủ để để cung cấp ion OH- với nồng độ thấp được áp dụng như một loại thuốc kháng axit. Độ hòa tan thấp giúp nó có thể trung hòa axit trong dạ dày một cách từ từ mà không tạo ra sự biến động pH quá nhanh, ngăn ngừa các tác dụng phụ không như ý. Đồng thời, Pb(OH)2 do độc tính chỉ được dùng đối với các ứng dụng công nghiệp được kiểm soát một cách chặt chẽ, nơi đặc điểm kết tủa của nó được sử dụng nhằm mục đích loại bỏ ion chì.
Tóm lại, mức độ tan của các hydroxit kim loại là một đặc điểm quan trọng quyết định phạm vi ứng dụng và hiệu quả của chúng trong những ứng dụng khác nhau. Việc nắm vững sự khác biệt này là rất quan trọng cho việc lựa chọn nguyên liệu thích hợp cũng như tối ưu hóa các quy trình công nghiệp.
Lời kết
Qua những phân tích trên, chúng ta đã cùng đi sâu tìm hiểu sự chênh lệch rõ rệt về khả năng hòa tan giữa Canxi Hydroxit (Ca(OH)2) so với một vài hydroxit kim loại khác ví dụ như Al(OH)3, Fe(OH)3, Mg(OH)2 và Pb(OH)2. Chúng ta đã nhận ra rằng Ca(OH)2 mang độ hòa tan cao hơn so với Al(OH)3, Fe(OH)3 và Mg(OH)2, trong khi Pb(OH)2 mang độ hòa tan biến đổi tùy thuộc vào điều kiện.
Sự khác biệt rõ rệt này không chỉ là một đặc điểm chỉ đơn thuần về mặt hóa học, mà còn có ý nghĩa thực tế sâu sắc cho việc lựa chọn và áp dụng các hydroxit kim loại trong những quy trình sản xuất công nghiệp khác nhau. Hiểu rõ đặc tính tính tan giúp tối ưu hóa hiệu quả phản ứng, quản lý quá trình kết tủa và điều chỉnh giá trị pH một cách chính xác.
Đối với các công ty đang hoạt động trong ngành hóa chất, việc chọn lựa nguyên liệu hydroxit thích hợp dựa trên yêu cầu và điều kiện của quy trình là yếu tố then chốt để đảm bảo hiệu quả sản xuất và chất lượng sản phẩm cuối cùng.
Chúng tôi tại GH Group tự hào là nhà cung cấp những sản phẩm hóa chất với chất lượng cao, bao gồm đa dạng những loại hydroxit kim loại. Với kinh nghiệm và kiến thức chuyên môn sâu sắc, chúng tôi luôn sẵn sàng tư vấn và cung cấp các giải pháp hóa chất tối ưu nhất với nhu cầu cụ thể của quý doanh nghiệp. Vui lòng liên hệ với chúng tôi để được hỗ trợ cũng như cùng nhau tối ưu hóa quy trình sản xuất và xử lý của bạn.